ФИЗИКО-ХИМИЧЕСКИЕ ЯВЛЕНИЯ ПРИ НИЗКИХ ДАВЛЕНИЯХ
Испарение и конденсация в вакууме
В условиях высокого вакуума с помощью этой формулы можно оценивать массу вещества, испаряющегося с 1 см2 поверхности за единицу времени, если известны температура и давление пара для равновесного состояния.
лекул Цр, ударяющихся о квадратный сантиметр поверхности вещества.
Ввиду равновесия такая же масса вещества будет испаряться в 1 сек с 1 см2 поверхности. Начав теперь откачку, мы устраняем конденсацию пара, но не изменяем испарение. Таким образом, формула (1.64) будет выражать скорость испарения вещества в вакууме.

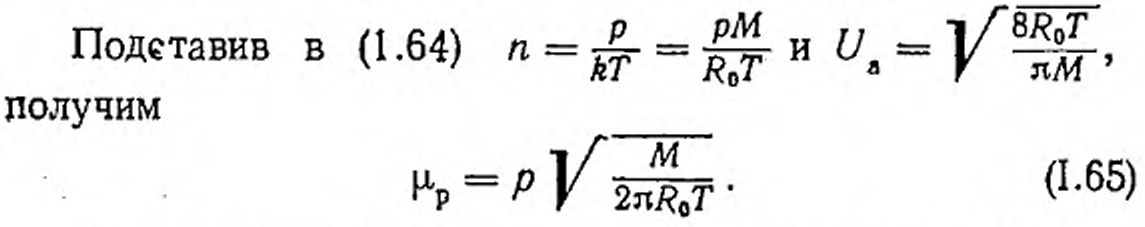
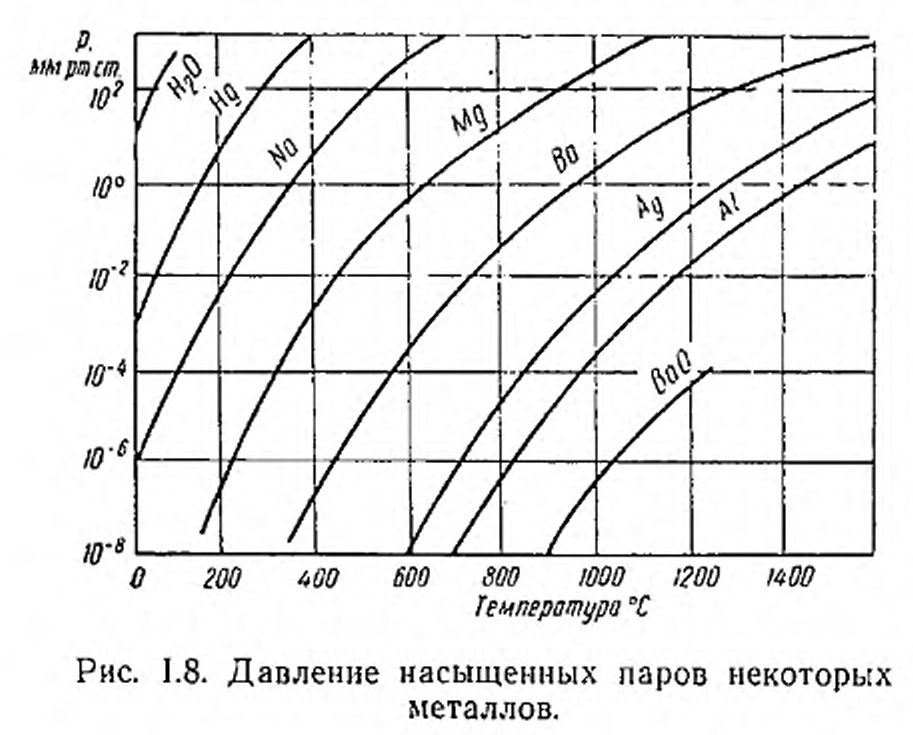
Сведения относительно давления паров различных материалов и скорости их испарения часто бывают необходимы в связи с исследованиями и промышленными разработками в физике и технике высокого вакуума, когда приходится иметь дело с металлами при высоких температурах или газами и парами при очень низких температурах. Количественное представление об упругостях насыщенных паров некоторых металлов и соединений, которые используются в вакуумной технике, можно получить из кривых рис. 1.8. Здесь мы видим, что различные вещества сильно отличаются друг от друга по величине давления (упругости) пара при одной и той же температуре. Упругость пара твердых веществ значительно ниже, чем жидкостей. Из рисунка также видно, что для всех веществ давление пара возрастает с температурой почти экспоненциально, что подтверждает применимость эмпирической формулы (1.63).
Когда температура стенок сосуда, в котором находится газ, ниже критической, последний может конденсироваться, и тогда также говорят об упругости пара. Если сосуд является частью вакуумной установки (например, ловушка, охлаждаемая жидким азотом), то тогда предельно достижимый уровень вакуума будет определяться упругостью пара сконденсированного газа на стенках этого сосуда. Кривые рис. 1.9 графически изображают давления насыщенных паров большинства газов, входящих в состав атмосферного воздуха, при температурах ниже критических.

и паров твердыми телами
Опыт показывает, что различные твердые тела поглощают значительные количества газа. Газ может проникать в глубь твердого тела, подобно тому как это происходит при растворении газа в жидкости. Такое глубинное удержание газа твердыми телами принято называть абсорбцией. Помимо этого, газ может также удерживаться поверхностью твердого тела с образованием пленки толщиной в один или несколько молекулярных слоев. Тогда говорят о явлении адсорбции. Абсорбция и адсорбция газов или паров «редко встречаются в чистом виде. В большинстве случаев поглощенный газ может частично находиться на поверхности, а частично диффундировать в толщу твердого тела. Поэтому в тех случаях, когда трудно установить характер механизма поглощения газа, употребляют более общий термин «сорбция», объединяющий оба понятия — адсорбцию и абсорбцию.
Твердые тела, поглощающие газ, иногда называют сорбентами или, если это явление разделимо, адсорбентами (абсорбентами). Поглощаемый же газ или пар называется сорбатом (адсорбатом или абсорбатом).
Обратный процесс удаления газа из сорбента (скажем, путем нагревания в вакууме) называют десорбцией.
Механизм поглощения газа при адсорбции может быть разным, так как в системах твердое тело — газ адсорбция обусловлена различными по природе силами. Адсорбция бывает физической или химической.
При физической адсорбции молекулы адсорбата сохраняют свою индивидуальность, а адсорбционные силы имеют ту же природу, что и межмолекулярное взаимодействие в газах, жидкостях и твердых телах. Адсорбированные молекулы газа принимают участие в тепловом (колебательном) движении атомов твердого тела и, следовательно, при достаточно большой амплитуде этого движения могут испаряться (десорбироваться) из поверхности твердого тела. Если ввести понятие среднего времени жизни молекулы в адсорбированном состоянии т, то число адсорбированных молекул на единице поверхности тела па должно быть пропорционально т и числу молекул, ударяющихся о единицу поверхности за единицу времени. Поэтому в откачанном до низкого давления объеме поверхностная концентрация молекул газа на адсорбенте будет выше, чем в объеме, и в этом случае говорят, что поверхность тела поглощает газ.
Поглощение газов
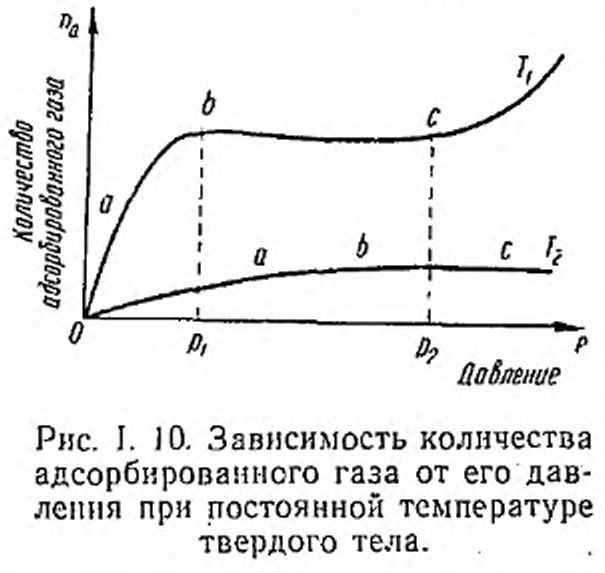
Какое количество газа может адсорбироваться на поверхности твердого тела? Опыт показывает, что для данного твердого тела адсорбция зависит от природы и давления газа. Количественную связь массы адсорбированного газа от давления (при постоянной температуре) получают из экспериментальных кривых — изотерм адсорбции. На рис. 1.10 показан типичный ход кривых адсорбции для двух температур Т} <Т2. На них можно выделить три характерные области: область низких давлений (участки Оа), область средних давлений (ab) и область высоких давлений (Ьс). На отрезках кривых Оа величина адсорбции пропорциональна давлению газа, а затем кривые переходят к насыщению (участки ab). В этих условиях поверхность твердого тела покрывается мономолекулярным слоем, т. е. слоем, толщина которого не превышает размеров одной молекулы (атома) газа. При дальнейшем увеличении давления происходит наращивание первого адсорбированного слоя, и адсорбированный газ может образовать пленку, состоящую из нескольких молекулярных слоев.
Состояния, отмеченные на изотермах адсорбций, из-за теплового движения атомов твердого тела являются состояниями динамического равновесия, когда некоторые адсорбированные молекулы постоянно покидают поверхность тела (десорбируются), а другие приходят из объема — адсорбируются. Как видно из рис. 1.10, для повышения адсорбционной способности твердого тела необходимо понижать его температуру, и, наоборот, если, мы хотим удалить адсорбированные газы (обезгазить данную поверхность), нужно нагревать твердое тело. Этими приемами широко пользуются в вакуумной технике для получения и поддержания низких давлений.
Иногда взаимодействие между газом и твердым телом напоминает химическую реакцию, тогда говорят о химической адсорбции. При этом действуют силы химической связи, отличные по своей природе от сил межмолекулярного взаимодействия и часто их даже превосходящие. Так, например, на пленку кислорода, образовавшуюся на вольфрамовой нити, водород практически не оказывает никакого воздействия даже при температуре 1500° С. Это говорит о том, что удерживаемый вольфрамовой нитью кислород действует совершенно не так, как в газообразном состоянии.
Между химической и физической адсорбциями существует различие еще и в том, что эффективность физической адсорбции с понижением температуры сильно возрастает, в то время как химическая адсорбция при недостаточно высоких температурах совсем не происходит и, наоборот, очень быстро усиливается с повышением температуры. При нагревании тела газ, связанный механизмом химической адсорбции, из него либо совсем не удаляется, либо удаляется очень плохо. При этом химический состав десорбированного газа отличается от адсорбированного.
Явление химической адсорбции называют также «хемосорбцией», так как количество тепла, выделяющееся при этом процессе, по порядку величины соответствует тепловым эффекталМ химической реакции.
При объемном поглощении газов твердыми телами (абсорбции) количество поглощенного газа растет пропорционально объему тела и зависит от его природы. Абсорбция газа твердым телом, исключая хемосорбцию и физическую адсорбцию, идет в направлении образования твердого раствора, т. е. проникновения молекул газа внутрь кристаллической решетки твердого тела.
Типичными абсорбентами газов, которые широко используются в вакуумной технике, являются металлы. В зависимости от условий они могут поглощать объемы газов, в сотни раз превышающие их собственный объем. Например, титан поглощает до 1800 объемов водорода при нормальных условиях (20° С и 760 мм рт. ст.), цирконий— 1500, палладий — 900, тантал — 750. Для этих металлов водород абсорбируется всегда в виде истинного раствора и пропорционально корню квадратному из давления, а не давлению р, как это было в случае физической адсорбции при низких давлениях (рис. I. 10). Так как при абсорбции с образованием твердых растворов нет явлений хемосорбции, то зависимость ее от Ур можно объяснить предположением, что молекулярные газы, диффундируя в металлы, диссоциируют на атомарные ком
поненты. Вследствие того, что абсорбированные газы проникают в глубь металла, через некоторый промежуток времени газ начнет проходить сквозь металл. Этот процесс диффузии газов через металлы зависит от природы метал-
где № — количество диффундируемого газа, объемные единицы за единицу времени;
а и b — константы для данной пары металл — газ;
d — толщина стенок;
р — давление у той поверхности металла, в которую входит газ,
Т — абсолютная температура.
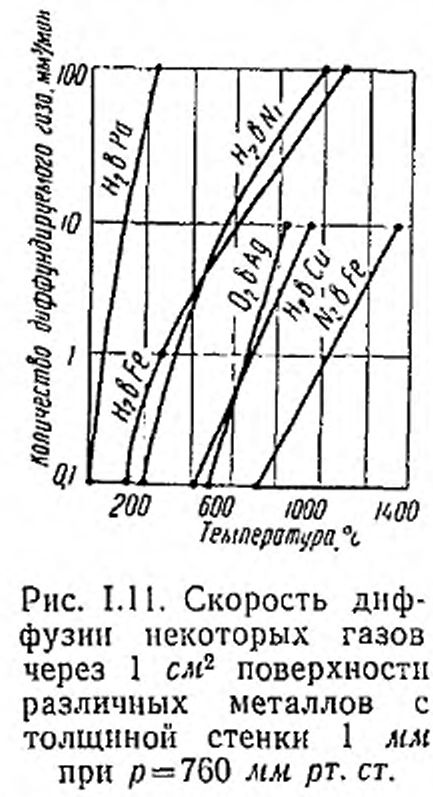
На рис. 1.11 приведены кривые, иллюстрирующие скорость диффузии для различных металлов и газов. Здесь обращает на себя внимание большая скорость диффузии водорода через палладий по сравнению с другими металлами. Так, при температуре ~220° С сквозь палладиевую стенку площадью 1 сл<2 и толщиной 1 мм за 1 мин прохо-дит 10 мм2 водорода, приведенного к 760 мм рт. ст. Этим свойством палладия пользуются для очистки и напуска

ла и газа, толщины стенок и связан с давлением газа и температурой металла уравнением

при электрическом разряде
Идея использования электрического разряда для поглощения газов известна давно. Уже в первых газоразрядных трубках низкого давления было замечено, что в процессе их горения нужно увеличивать напряжение, необходимое для прохождения тока, а через некоторое время они вовсе становились «непроводящими». Подобное явление наблюдалось и в газонаполненных рентгеновских трубках. Так как в последнем случае вынужденное повышение напряжения вызывало увеличение проникающей способности (жесткости) рентгеновских лучей, то явление поглощения газа при токопрохождении через разреженный газ получило название «жестчения».
Для того чтобы понять явление поглощения газа при электрическом разряде, необходимо вкратце рассмотреть механизм электрической проводимости, который происходит, например, в трубке с тлеющим разрядом. Здесь носителями электрических зарядов являются как электроны, так и положительные, ионы. Однако благодаря большей подвижности и меньшей массе электроны переносят значительно большую часть тока, а ионы в разряде с холодным катодом выполняют роль поставщиков электронов.
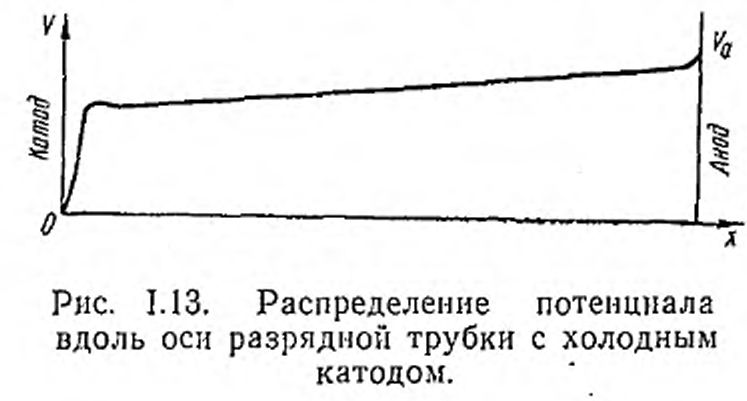
В самом деле, при установившемся распределении потенциала между катодом и анодом, показанном на рис. 1.13, основная часть приложенного напряжения приходится на довольно узкий катодный слой. В остальной же части трубки (положительном столбе или плазме разряда) градиент потенциала сравнительно мал. В этих условиях ионы из плазмы направленным потоком двигаются в сторону катода, попадают в катодный слой и дополнительно ускоряются в нем до энергии, равной величине катодного падения потенциала. Поскольку катодный скачок потенциала обычно равен нескольким сотням вольт,
Связывание газов
водорода в вакуумную систему через нагретую палладиевую трубку с помощью устройства, показанного на рис. 1.12. Аналогичные устройства можно применять для кислорода, пропуская его через нагретую серебряную трубку, азота и СО2, пропуская через нагретую железную трубку, и др.
ускоренные до такой энергии ионы, ударяясь о поверхность катода, выбивают из него вторичные электроны. Последние, проходя катодную область разряда, ускоряются, затем попадают в положительный столб, где и растрачивают полученную энергию на возбуждение и ионизацию атомов газа-наполнителя (иначе говоря, «термализуются»).
Кроме вынужденного движения ионов по полю в сторону катода, в разряде имеет место направленный поток
ионов и электронов на стенки разрядной трубки. Но так как стенка всегда заряжена до некоторого отрицательного потенциала, то здесь ионы также ускоряются и попадают на нее с повышенной скоростью по сравнению со средней скоростью теплового движения ионов в положительном столбе разряда.
Таким образом, в газоразрядных приборах всегда возникают специфические условия, при которых часть газа находится в ионизованном состоянии и положительные ионы с некоторой направленной скоростью попадают на катод, отрицательные электроды и стенки разрядной трубки.
Опыт показывает, что если газ находится в ионизованном состоянии, то процесс поглощения его механизмами физической и химической адсорбции протекает с большей эффективностью. Кроме того, при интенсивной ионной бомбардировке происходит распыление отрицательных электродов с образованием пленок распыленного вещества на стенках и электродах газоразрядного прибора. Эти пленки могут дополнительно адсорбировать и абсорбировать достаточно большие количества остаточного газа. Если процесс бомбардировки электродов продолжается непрерывно, то наслаивающиеся пленки распы
ленного вещества «замуровывают» насыщенные газом ранее образованные слои, и тогда явление поглощения газа становится необратимым. Как мы увидим ниже, этим явлением широко пользуются при конструировании ионно-сорбционных насосов.
Наблюдаемое снижение давления во времени при поглощении газов в электрическом разряде также следует экспоненциальному закону. Однако оно происходит гораздо быстрее, а минимальный уровень его намного ниже, чем при обычном поглощении газа твердыми телами. Это хорошо ил л ю стр и р уют кривые рис. 1.14. Здесь кривая I описывает явление обычной адсорбции, а кривая 2 — поглощение газа при электрическом разряде (шкала времени показана условно).
Не следует также забывать, что адсорбированные газы не удаляются из объема и после прекращения разряда (или повышения температуры) могут десорбироваться и снова попасть в объем газоразрядного прибора.